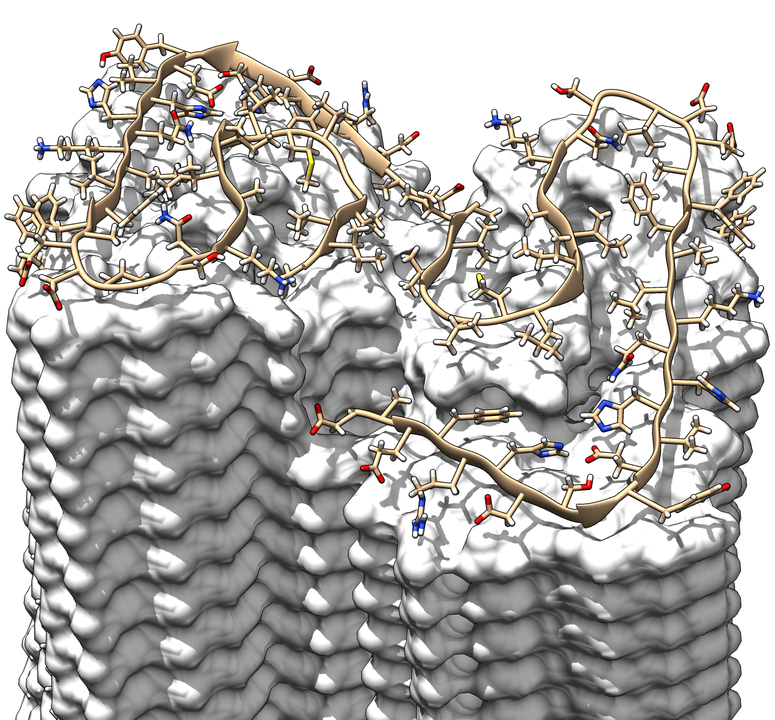
Die mittels Kryo-Elektronenmikroskopie gewonnene Struktur zeigt, wie sich die scheibchenweise übereinanderliegenden Eiweißbausteine, sogenannte "Aβ-Proteine", zu Fasern anordnen, die auch als "Protofilamente" bezeichnet werden. Je zwei dieser sich umeinander drehenden Protofilamente bilden gemeinsam eine Fibrille aus. Wenn sich mehrere dieser Fibrillen miteinander verknäueln, entstehen die typischen Ablagerungen oder "Plaques", wie sie sich im Gehirngewebe von Alzheimer-Patienten nachweisen lassen.
Die jetzt erzielte Auflösung von 4 Angström, das entspricht 0,4 Nanometer, liegt im Bereich der typischen Größenordnung von Atomradien und Atombindungslängen. Das Modell zeigt anders als bisherige Arbeiten erstmals die genaue Lage und die Wechselwirkungen der Proteine untereinander. Zudem lassen sich in dem Modell erstmals alle 42 Aminosäurereste identifizieren, aus denen jedes einzelne Aβ-Protein besteht.
Damit gibt es nun eine neue Basis, den strukturellen Effekt einer Reihe von genetischen Veränderungen zu verstehen, die das Krankheitsrisiko erhöhen: Sie stabilisieren die Fibrillen – wie man jetzt sehen kann – durch Änderungen im Bauplan des Proteins an definierten Stellen. Umgekehrt erklärt sich auch, warum Mäuse in der Natur kein Alzheimer bekommen oder eine kleine isländische Bevölkerungsgruppe beinahe resistent gegen die Krankheit zu sein scheint: Ihre Varianten des Proteins unterscheiden sich in einer oder mehreren Aminosäuren, die für den Zusammenhalt der Fibrillen anscheinend maßgeblich von Bedeutung sind.
Ihre Entdeckung haben die Forschenden am 7. September 2017 im Fachmagazin "Science" veröffentlicht.
Kontakte:
Dr. Lothar Gremer
Heinrich-Heine-Universität Düsseldorf und Institute of Complex Systems (ICS-6), Forschungszentrum Jülich
Jun.-Prof. Gunnar Schröder
Heinrich-Heine-Universität Düsseldorf und Institute of Complex Systems (ICS-6), Forschungszentrum Jülich
Prof. Dieter Willbold
Heinrich-Heine-Universität Düsseldorf und Institute of Complex Systems (ICS-6), Forschungszentrum Jülich
Prof. Henrike Heise
Biomolekulare Festkörper-NMR-Spektoskopie, Heinrich-Heine-Universität Düsseldorf und Institute of Complex Systems (ICS-6), Forschungszentrum Jülich
Der Artikel ist unter http://science.sciencemag.org/lookup/doi/10.1126/science.aao2825 in Englisch veröffentlicht. Die Quellennachweise und die Zusammenfassung sind mit diesem Link kostenlos verfügbar; der vollständige Text kann ggfs. nur gegen Bezahlung verfügbar sein.
The article is available from http://science.sciencemag.org/lookup/doi/10.1126/science.aao2825 in English only. The citation data and abstract are available free of charge from the same link; access to the full text may require a subscription.